指針・関連法規など
1.薬機法の対象となる臨床試験等
医薬品・医療機器・再生医療等製品(医薬品等)として製造販売するためには、国の承認が必要となります。 その際に人を対象として実施する臨床試験のことを「治験」と呼びます。なお、製造販売承認を得た後もその医薬品等の安全性や有効性を継続して調査する臨床試験のことを、「製造販売後臨床試験」「製造販売後調査」などと呼びます。
治験や製造販売後臨床試験・製造販売後調査を実施するには、以下の法令等を遵守して行います。
- 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法)
- 医薬品の臨床試験の実施の基準に関する省令
- 医薬品の製造販売後の調査及び試験の実施の基準に関する省令
2.臨床研究法の対象となる臨床研究
「臨床研究法」における、臨床研究とは「医薬品等を人に対して用いることにより、当該医薬品等の有効性又は安全性を明らかにする研究」と定義されており、このうち特定臨床研究とは、以下の2つのいずれかに該当する研究を指します。
- ①薬機法における未承認・適応外の医薬品等の臨床研究
- ②製薬企業等から資金提供を受けて実施される当該製薬企業等の医薬品等の臨床研究
3.再生医療法の対象となる治療と臨床研究
再生医療とは、機能障害や機能不全に陥った生体組織・臓器に対して、細胞や組織を培養・加工等を行って移植し、その機能を回復させる医療のことを言います。これら医療には、治療として実施するものと臨床研究として実施するものがあります。いずれを実施する場合にあっても、「再生医療等の安全性の確保等に関する法律(再生医療法)」を遵守して行う必要があります。
4.人を対象とする医学系研究
上記1~3に含まれない、人を対象とする医学系研究については、「人を対象とする医学系研究に関する倫理指針」を遵守して実施します。例えば、人の血液や組織などを用いてあるマーカーの探索を行う研究や、カルテなどの診療情報を用いて疾患の治療成績などを調査する研究などがあります。なお、人の血液などの生体試料を用いて遺伝子解析を行う場合には、「ヒトゲノム・遺伝子解析研究に関する倫理指針」を遵守する必要もあります。
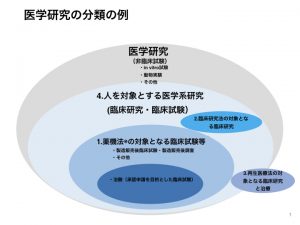
日本医師会雑誌第135巻より引用、一部改変
