審査手続き等ご案内
審査等業務の依頼について
研究代表医師(研究責任医師)は、認定臨床研究審査委員会より審査結果通知書を受領したのち、実施医療機関の管理者の許可を得たうえで、jRCT上で作成した実施計画に押印し、厚生労働大臣へ届け出を行う必要があります。
特定臨床研究の実施を検討する前に、下記URLより臨床研究法(平成29年法律第16号)の概要及び関連法規等をご確認ください。
| 臨床研究法について(厚生労働省ホームページ) |
審査等業務の依頼には、以下の審査料が発生致します。
単位(円)
| 申請の種類 | 審査手数料 |
|---|---|
| 新規課題審査手数料 (疾病等報告を含む。) |
350,000 |
| 継続課題審査手数料 (疾病等報告、定期報告含む。) |
170,000 |
※単施設での研究または他施設共同研究における主施設としての審査手数料のみ抜粋。
審査依頼からの流れ
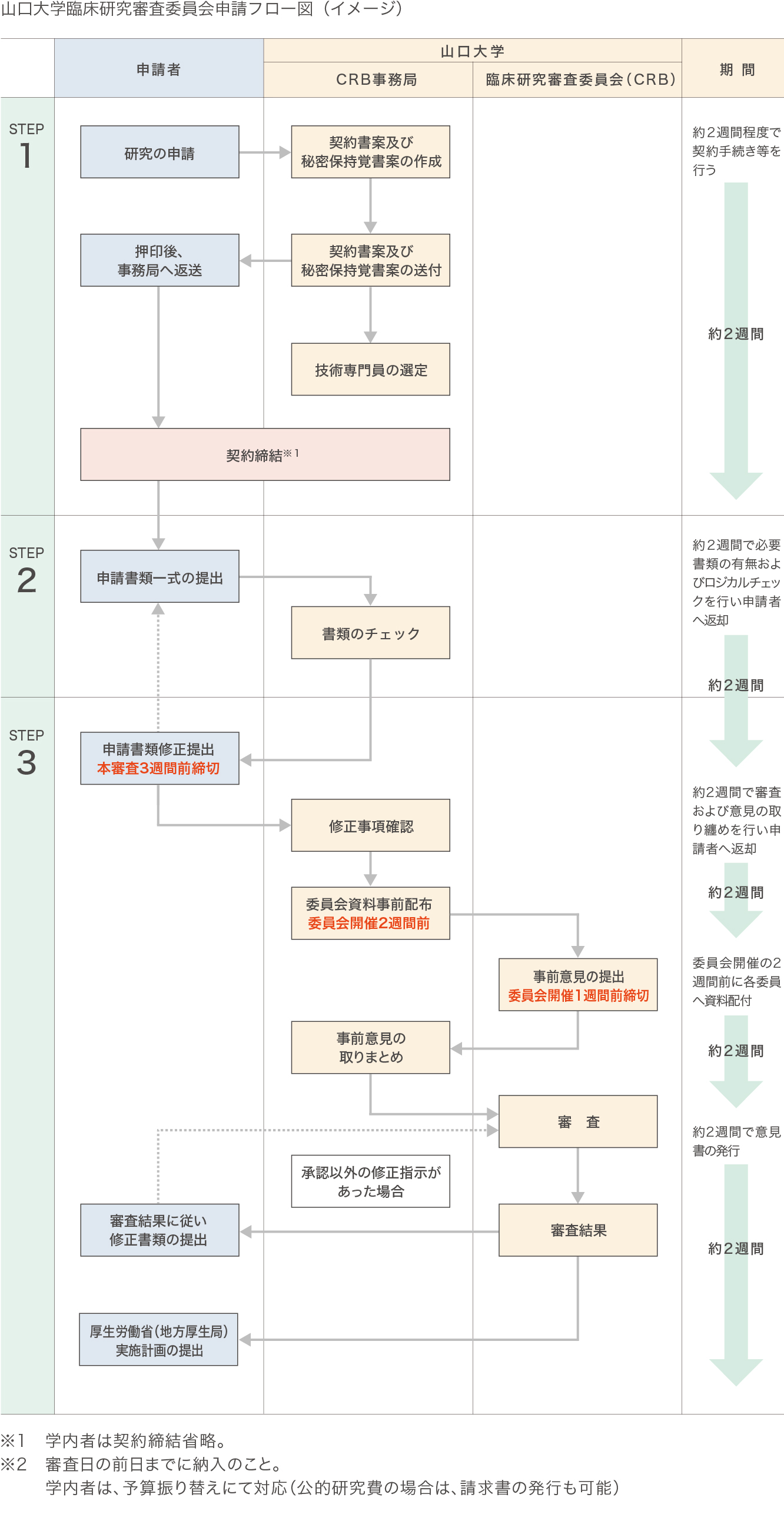
【STEP1】申し込み
【STEP2】事前チェック
【STEP3】本審査
研究開始後
様式一覧
| 様式番号 | 様式名 |
|---|---|
| 統⼀書式1 | 研究分担医師リスト |
| 統⼀書式2 | 新規審査依頼書 |
| 統⼀書式3 | 変更審査依頼書 |
| 統⼀書式4 | 審査結果通知書 |
| 統⼀書式5 | 定期報告書 |
| 統⼀書式6 | ⽋番 |
| 統⼀書式7 | 重⼤な不適合報告書 |
| 統⼀書式8 | 医薬品の疾病等報告書 |
| 統⼀書式9 | 医療機器の疾病等⼜は不具合報告書 |
| 統⼀書式10 | 再⽣医療等製品の疾病等⼜は不具合報告書 |
| 統⼀書式11 | 中⽌通知書 |
| 統⼀書式12 | 終了通知書 |
| 統⼀書式13 | 認定臨床研究審査委員会の意⾒報告書 |
| 統⼀書式14 | 軽微変更通知書 |
| – | 詳細記載⽤書式 |
| 参考資料1 | 技術専⾨員評価書 |
| 参考資料2 | 実施医療機関の要件 |
| 参考資料3 | 技術専⾨員就任依頼書 |
| 参考資料4 | 履歴書 |
最新の書類は厚⽣労働省 臨床研究法ホームページ参照
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000163417.html
